- Modelos Atômicos:
- A primeira ideia de átomo veio da antiguidade pelos filósofos gregos Demócrito e Leucipo através do pensamento e não com bases científicas. Átomo = indivisível
- Dalton(Bola de bilhar): Disse que os átomos eram esferas rígidas e indivisíveis e que cada elemento na natureza possui um tipo de átomo, como por exemplo a água, os átomos da água seriam esferas lisas pois ela escorrega pelo nossa mão e etc.
- J.J. Thomson(Pudim de passas): Esse cientista,após realizar uma série de experimentos científicos com descargas elétricas em gases, concluiu que qualquer matéria, independente de suas propriedades, continha partículas de massa muito menores que o átomo de Hidrogênio. Verificou também, que estas partículas tinham carga negativa e que, em determinadas circunstâncias, podiam ser extraídas dos átomos. Este conjunto de informações levou-o a sugerir que a estrutura do átomo seria semelhante a uma esfera de carga positiva, na qual havia corpúsculos (elétrons) de carga negativa, distribuídos uniformemente, algo semelhante a um “Pudim de Passas”.
- Rutherford(Modelo Planetário): A descoberta inicial foi feita por Hans Geiger e Ernest Marsden em 1909, ao realizarem o experimento da folha de ouro sob a supervisão de Rutherford. Eles dispararam um feixe de partículas alfa (núcleos de hélio) contra camadas de folhas de ouro com apenas alguns átomos de espessura. Esperava-se que os átomos colidissem e voltassem mas isso não aconteceu: ele saíram em todas as direções porque a maior parte do átomo é vazia, assim sendo poderiam passar, colidir e voltar ou colidir e mudar sua trajétoria.
- Rutherford-Bohr: O modelo de Rutherford tinha alguns defeitos, entre eles o fato de que se os elétrons possuem carga negativa e giram em torno do núcleo que é positivo, logo eles perderiam energia em forma de radiação e colidiriam no núcleo. Por isso Bohr propôs 3 leis:
- Os elétrons não se movem aleatoriamente ao redor do núcleo, mas sim em órbitas circulares, sendo que cada órbita apresenta uma energia bem definida e constante (nível de energia) para cada elétron de um átomo. Quanto mais próximo do núcleo, menor a energia do elétron, e vice-versa;
- Os níveis de energia são quantizados, ou seja, só são permitidas certas quantidades de energia para o elétron cujos valores são múltiplos inteiros do fóton (quantum de energia ou no plura quanta);
- Para passar de um nível de menor energia para um de maior energia, o elétron precisa absorver uma quantidade apropriada de energia. Quando isso ocorre, dizemos que o elétron realizou umsalto quântico e atingiu um estado excitado. Esse estado é instável e quando o elétron volta para o seu nível de energia original (estado fundamental), ele libera a energia que havia absorvido na forma de onda eletromagnética.
OBS: Na mecânica quântica, Heisemberg contestou Bohr por causa de seu princípio da incerteza, afinal, não podia-se saber com precisão aonde estava o elétron. Criou-se então o conceito de orbital, o lugar de maior probabilidade de estar o elétron.
Átomos e Íons
Alguns conceitos são necessários antes de adentrarmos no assunto:
- Prótons: partes dos átomos com carga positiva. Faz parte do núcleo junto com os nêutrons.
- Nêutrons: partes dos átomos com carga neutra.
- Elétrons: partícula subatômica com carga negativa. Ele gira em torno do núcleo.
- Massa do núcleo = A
- Número atômico = Z
- Prótons = P, Nêutrons = N e Elétrons = é
- A massa de um átomo é medida através da soma da massa dos prótons e nêutrons: A = P + N
- Íons são espécies químicas que perderam(Ânion) ou ganharam(Cátion) elétrons. Exemplo: Na+, Cl-
OBS: Se for dito que dois átomos têm mesma massa então eles são ISÓBAROS. Se for número atômica igual então eles são ISÓTOPOS(isotopos sempre serão átomos do mesmo elemento) e se for o mesmo número de nêutrons eles serão ISÓTONOS OU ISONEUTRÔNICOS.
Voltando a falar de Bohr, ele propos a ideia dos orbitais que estão assim:
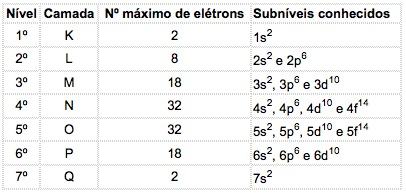
COMO EU VOU DECORRAR ISSO????????????? = Sem Pão Dá Fome!!!!!
Irei explicar a parte de Ligações Químicas quando estiver abordando a Tabela Periódica.
Até a próxima, xau!